
Atom, maddenin temel yapı taşı olarak kabul edilir. Kütlesi olan her şey, yani boşlukta yer kaplayan her şey atomlardan oluşur. Adı başlangıçta artık bölünemeyen bir parçacığa (mümkün olan en küçük şey) atıfta bulunurken, artık her atomun genellikle daha küçük parçacıklardan oluştuğunu biliyoruz.
Bu parçacıklara, atom altı parçacıklar denir. Üç adet atom altı parçacık vardır: protonlar, nötronlar ve elektronlar.
Elektrik yüküne sahip iki atom altı parçacık vardır: protonlar pozitif yüke, elektronlar ise negatif yüke sahiptir. Nötronların ise yükü yoktur. Temel bir kural, aynı yüklü parçacıklar birbirini iterken, zıt yüklü parçacıklar birbirini çeker.
Atomların varlığı ilk olarak MÖ 400 kadar erken bir tarihte, Yunan filozoflar tarafından tahmin edildi. MÖ 450 civarında, Yunan filozofu Demokritos, tüm maddelerin atomos adı verilen küçük ve bölünmez parçacıklardan oluştuğunu öne sürdü. Fikirleri çok fazla eleştiriyle karşılandı.
Erken Atom Modeli
Kütlenin korunumu yasası, belirli oranlar yasası ve çoklu oranların yasası, kimyasal reaksiyonların davranışı için modeller sağlamıştır, ancak yasalar açıklanamamıştır. 1808'de John Dalton (1766-1844) bu fenomen için bir açıklama işlevi gören atom teorisini önerdi. Teorisi beş önermeden oluşur.
İlk varsayım, tüm maddelerin atomlardan oluştuğunu belirtir. İkincisi, belirli bir elementin atomlarının hepsi yapı ve özelliklerde tamamen aynıdır. Üçüncüsü, atomlar daha fazla bölünemez, yaratılamaz veya yok edilemez. Dördüncüsü, farklı elementlerin atomları bileşikler oluşturmak için birleşir.
Son olarak, kimyasal reaksiyonlar atomların kombinasyonunu, ayrılmasını ve yeniden düzenlenmesini içerir. Bu beş önermede sadece kütlenin korunumu, belirli oranlar ve çoklu oranlar açıklanmakla kalmadı, aynı zamanda çeşitli atom modellerinin araştırılması ve geliştirilmesi için de temel oluşturuldu.
Dalton’ un atom teorisinin tamamı zamanın testini geçemedi. Atomun tarihsel gelişimi, atomların daha küçük parçacıklara bölünebildiğini ve belirli bir elementin tüm atomlarının tam olarak aynı olmadığını gösterdi.
1800'lerin sonunda, bilim insanları atomların protonlar, nötronlar ve elektronlar olarak adlandırılan üç atomaltı parçacıktan oluştuğunu keşfettiler.
Protonlar ve nötronlar atomun çekirdek adı verilen merkezi bir bölgesinde bulunur ve elektronlar çekirdeği çevreleyen alanda yer alırlar. Bu parçacıkların her birinin atom içindeki sayısı ve düzeni elemanın kimyasal özelliklerini belirler.
Aynı elementin atomları nötron sayısında (izotop olarak adlandırılır) ve ayrıca elektron sayısında (iyon olarak adlandırılır) farklılık gösterebilir.
Dalton'un atom teorisi ile birlikte bu atomaltı parçacıkların keşfi, birkaç atom modelinin gelişimini harekete geçirdi. Modern fizikteki ilerlemeler, bilim insanlarının protonları ve nötronları oluşturan temel atom altı parçacıkları olan kuarklar da dahil olmak üzere çok sayıda atomaltı parçacık bulmalarını sağladı.
Elektronun Keşfi
İlk atomaltı parçacığın, elektronun keşfi, elektriğin madde üzerindeki etkilerini içeren deneylerden kaynaklandı. 1800'lerin sonlarında katot ışınlı tüp geliştirilmiş ve çeşitli araştırmalarda kullanılmıştır. Katot ışın tüpü, düşük basınçta gaz içeren kısmen boşaltılmış bir cam tüptür.
Tüpün bir ucunda bir katot, diğer ucunda bir anot bulunur. Katot ve anot bir voltaj kaynağına bağlanır. Voltaj kaynağı, içeride sıkışan gazdan geçirilebilen bir akım oluşturur.
İlk deneyler, akımın, katodun tam karşısındaki tüp yüzeyinin parlamasına neden olduğunu gösterdi. Katottan kaynaklanan ve anoda doğru hareket eden bir parçacık akımının parıltıya neden olduğu varsayılmıştır. Bu parçacık akışına katot ışını denir.
Bir kürek çarkı tüpe yerleştirildiğinde katottan anoda yuvarlandı, bu da katot ışınını oluşturan parçacıkların kütleye sahip olduğunu gösterdi.
Manyetik bir alana maruz kaldığında, katot ışını, negatif bir yüke sahip bir elektrik akımı ile aynı şekilde saptırıldı. Bu nedenle, bir katot ışını oluşturan parçacıkların sadece kütleye değil aynı zamanda negatif bir yüke sahip olduğu sonucuna varılmıştır.
İngiliz fizikçi Joseph John Thomson (1856-1940) bu bulguları 1897'de doğruladı. Thomson, ışınların değişken manyetik ve elektrik alanlarla sapmasını ölçerek katot ışınını oluşturan parçacıkların kütlelerine yükünün oranını belirleyebildiği bir dizi deney gerçekleştirdi.
Thompson aynı deneyleri katot ve anot için farklı metallerin yanı sıra tüp içindeki farklı gazları kullanarak gerçekleştirdi. Deneyleri sapma miktarının matematiksel olarak tahmin edilebileceğini gösterdi.
Thomson, kullanılan malzemeden bağımsız olarak yük-kütle oranının her zaman aynı olduğunu buldu. Daha sonra tüm katot ışınlarının aynı parçacıklardan oluştuğu sonucuna vardı. İngiliz fizikçi G. Johnstone Stoney (1826-1911) tarafından elektron olarak adlandırıldı.
Chicago Üniversitesi'nden Amerikalı fizikçi Robert A. Millikan (1868–1953) Thomson’un sonuçlarını daha da doğrulayan deneyler yaptı. 1909 yılında yaptığı “yağ damlacık” deneyleriyle bir elektronun kütlesinin bir hidrojen atomunun kütlesinin yaklaşık iki binde biri olduğunu keşfetti.
Deneylerde, yağ damlacıklarına negatif yük vermek için x ışınları kullandı. Daha sonra bu damlacıkları bir cihazdan püskürterek elektrik yüklü iki plaka arasına düşmelerine izin verdi. İki plakadaki yükü değiştirdi ve bu değişikliğin damlacıkların düşme oranını nasıl etkilediğini ölçtü.
Bu verileri kullanarak, her bir yağ damlacığının yükünün her seferinde aynı sayının katları olduğunu hesapladı ve bunun tek bir elektronun yükü olması gerektiği sonucuna vardı.
Bu sayıyı ve Thompson’un yük / kütle oranını kullanarak bir elektronun kütlesini hesaplayabildi. Katot ışınları kullanılan herhangi bir gaz için aynı sapmayı gösterdiğinden, elektronların tüm elementlerin atomlarında bulunması gerektiğine karar verdi.
Elektronlar negatif bir yüke sahip olduğundan ve tüm atomlar elektriksel olarak nötr olduğundan, atomda da pozitif bir yük bulunmalıdır.
Ayrıca, bir elektronun kütlesi bütün bir atomun kütlesinden çok daha küçük olduğu için, kütlesinin çoğunu açıklamak için atomda bulunan başka parçacıklar olmalıdır. Bu sonuçlar, atomların gerçekten bölünebilir olduğunu ve ilk atom modelinin temelini gösteren ilk sonuçlardır.
İlk Atom Modelleri
Thomson bu sonuçları 1903-1907 yılları arasında atomun “erik pudingi” modelini formüle etmek için kullandı. Bu model, ilk kez 1902'de Lord Kelvin (1824-1907) tarafından önerilen benzer bir modelin bir uyarlamasıydı.
Bu modele göre, bir atomun negatif yüklü elektronları, erik pudingine gömülü eriklere benzer şekilde pozitif yüklü bir malzeme içinde bulunur.
Elektronlardan biri yer değiştirirse, orijinal konumuna geri dönecektir. Bu, nötr bir atomun kararlı bir modelini sağlamıştır. Aynı zaman diliminde, Japon fizikçi Hantaro Nagoaka Satürn atom modelini geliştirdi. 1904 yılında Nagaoka, bir atomun Satürn gezegenine benzemesini önerdi.
Gezegenin kendisi, etrafında elektron halkalarının dolaştığı bir pozitif yük bölgesiydi. Bu modele göre atom kararsızdı çünkü pozitif bir yükün etrafındaki halkalarda hareket eden elektronlar yavaş yavaş enerji kaybedecek ve sonunda merkez bölgeye düşecekti.
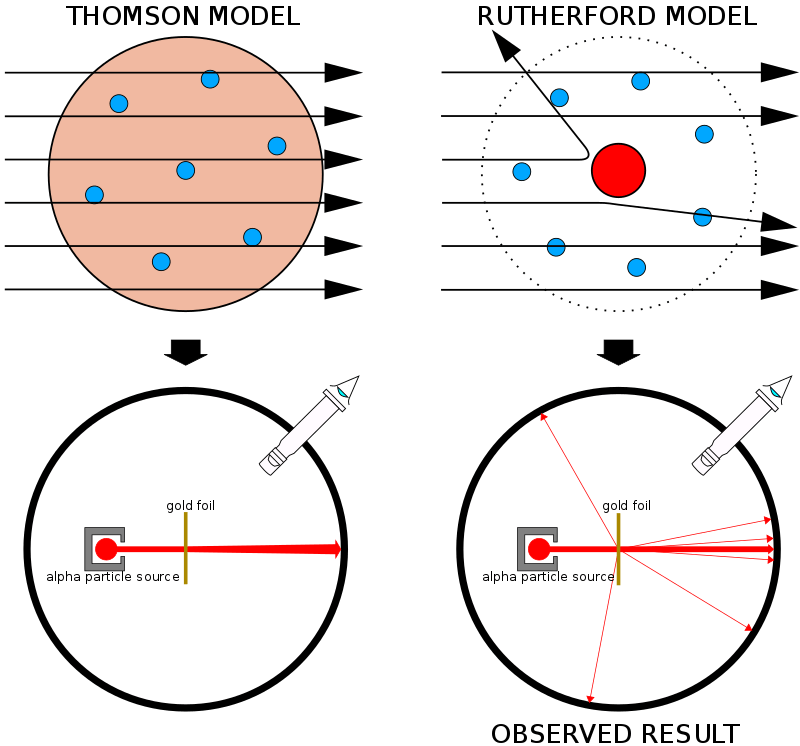
Thomson'ın "erik pudingi" modeli Nagaoka'nın "Satürn" modeline karşı bir oyun kazandı, ancak sadece birkaç yıllığına kabul edildi. 1911'de Yeni Zelandalı bilim insanı Ernest Rutherford (1871-1937) ünlü altın folyo deneylerine dayanarak kendi atomik modelini önerdi.
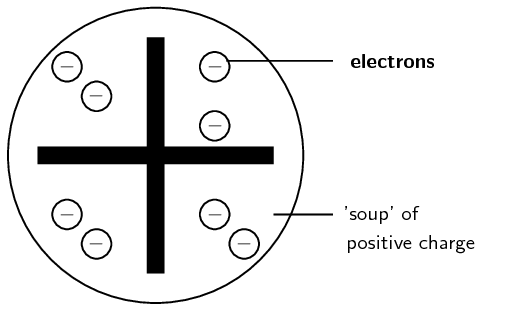
Erikli Puding modeline göre atom.
Rutherford, meslektaşları Hans Geiger (1882-1945) ve Ernest Mardsen ile birlikte, ince bir altın varak tabakasına alfa parçacıkları akışı hedefledi. Alfa parçacıkları pozitif bir yüke (+ 2) sahiptir ve bir hidrojen atomunun yaklaşık dört katıdır.
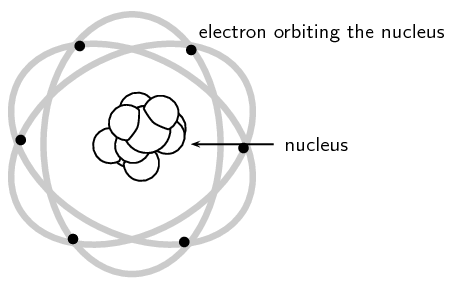
Rutherford'un atom modeli.
Hipotezleri, alfa parçacıklarının minimum sapma ile altın folyodan geçeceği, çünkü kütle ve yük Thomson tarafından önerildiği gibi bir atom boyunca eşit olarak dağıtıldı. Veriler bu varsayımla aynı fikirde değildi.
Bazı alfa parçacıkları altın folyodan geçerken büyük açılarda saptırılmıştır. Daha da şaşırtıcı olan, 8.000 parçacıktan yaklaşık biri doğrudan kaynağa doğru saptırıldı. Rutherford'un açıkladığı gibi, “sanki bir kağıt mendiline 15 inç (38 cm) top mermisi ateşlediniz ve geri döndü ve sizi vurdu.”
Sapmış alfa parçacıklarının yoğun şekilde paketlenmiş pozitif bir yük ile temas etmesi gerektiğini öne sürdü. Bu pozitif yük bölgesine çekirdek diyordu.
Çekirdek, elektronların güneş gibi daire içine aldığı dairesel boşluklarla çevrilidir. Bu deneyler atomun küçük bir çekirdeğe sahip olduğunu gösterdi. Minimum boyutuna rağmen, çekirdek atom kütlesinin çoğunu içeriyordu.
Bu model fizikçiler tarafından geniş ölçüde kabul görmedi çünkü atomun bu kadar küçük bir kısmının kütlenin çoğunu nasıl taşıyabileceğini açıklamak zordu.
Ayrıca çekirdeğin yükünün, Dmitri Mendeleev’in elementlerin periyodik tablosu ile aynı fikirde olmayan atomun özelliklerini belirlediğini öne sürdü.
Mendeleev'e göre, elementin atomik kütlesi çekirdeğin yükünü değil özelliklerini belirledi. Ayrıca, negatif yüklü elektronların pozitif yüklü çekirdeğe düşmesini neyin engellediğini açıklamamıştır.
Protonun Keşfi
İngiliz bilim insanı Henry Gwyn Jeffreys Moseley (1887-1915) kısa süre sonra atomun özelliklerini belirleyen nükleer yükün gizemini çözdü. Moseley, 1913'te her elementin çekirdeğinde benzersiz bir pozitif yük içerdiğini keşfetti. Atomun çekirdeği, proton adı verilen pozitif yüklü parçacıklar içermelidir. Bu nedenle, çekirdeğindeki yük miktarı veya proton sayısı bir elementin kimliğini belirler.
Çekirdekteki proton sayısına atom numarası denir. Moseley, periyodik tablonun atom kütlesini artırmak yerine artan atom sayısı sırasına göre düzenlenmesi gerektiğini söyledi. Bu düzenleme, yeni elementlerin henüz keşfedilmediği yerlerin doğru tahminleriyle birlikte tam bir periyodik tabloya izin verdi.
Nötronun Keşfi
Protonun keşfi başka bir gizemle sonuçlandı. Hidrojen atomunun kütlesinin, bir proton ve bir elektronun kütlesinden daha büyük olduğu biliniyordu. Bilim insanları, atomun kütlesine de katkıda bulunan başka bir parçacığın atom çekirdeğinde bulunması gerektiğini varsayarak eksik kütlenin kaynağını araştırdılar.
Pozitif yüklü protonlar, negatif yüklü elektronların yüklenmesini iptal ettiği ve bir bütün olarak atomun nötr olduğu için bu parçacık nötr olmalıdır. Elektriksel olarak nötr olduğundan, bu eksik parçacığın tespiti problemlidir. Elektron keşfedildikten yaklaşık 30 yıl sonra bu üçüncü parçacık bulundu.
Irene Joliot-Curie (1897-1956), bir berilyum örneğini alfa parçacıkları ile bombaladığı deneyler yaptı. Bu deneyler, alfa parçacıklarının demetinden daha yüksek nüfuz etme gücüne sahip yeni bir ışın ile sonuçlandı. 1932'de İngiliz bilim insanı James Chadwick (1891-1974) bu yeni ışının protonlarla yaklaşık olarak aynı kütleye sahip parçacıklardan oluştuğunu keşfetti.
Ayrıca, manyetik veya elektrik alanlar bu ışını saptıramazdı. Chadwick, ışının nötron olarak adlandırdığı protonlarla yaklaşık aynı boyutta nötr parçacıklardan oluşması gerektiği sonucuna vardı.
Nötronlar, protonlarla birlikte atomun çekirdeğini oluşturur ve kütlesinin çoğuna katkıda bulunur. Elektronlar, hacminin çoğunu oluşturan atomu çevreleyen boş alanda bulunur. Elektronun kütlesi, protonların ve nötronların kütlesine kıyasla önemsizdir.
Maddenin İkili Doğası
Protonun keşfiyle bile, Rutherford’ un atom modeli hala elektronların çekirdeğin etrafında nasıl sabit yörüngelere sahip olabileceğini açıklamıyordu. Alman fizikçi Max Planck (1858-1947) tarafından matematiksel bir sabitin geliştirilmesi, bir sonraki atom modelinin temelini oluşturdu.
Planck, 1900 yılında sıcak nesnelerden ışığın nasıl yayıldığını açıklarken sabitini geliştirdi. Elektromanyetik radyasyonun sadece kuant olarak adlandırdığı belirli enerji miktarlarıyla ilişkili olabileceğini varsaydı. Bir atom tarafından kaybedilen veya kazanılan enerji, minimum miktarda enerji içeren bir “paket” olarak düşünülebilecek bir kuantumda meydana gelmelidir.
Bir kuantum enerji ve E = hλ denklemiyle matematiksel olarak yayılan radyasyonun frekansı arasındaki ilişkiyi tanımladı (burada E, joule cinsinden bir kuantum radyasyonun enerjisi ve λ radyasyonun frekansıdır). H harfi Planck’ın sabitini simgeler.
1905'te Albert Einstein (1879-1955) ışığın ikili bir doğaya sahip olduğunu belirten bir teori geliştirdi. Işık sadece bir dalga olarak değil aynı zamanda bir parçacık olarak da hareket eder.
Her ışık parçacığı kendisiyle ilişkili bir kuantum enerjiye sahiptir ve buna foton denir.Bir fotonun enerjisi Planck denklemi kullanılarak ifade edilebilir.
Einstein’ın hipotezi, akım bir katot ışın tüpündeki bir gazdan geçtiğinde yayılan ışığın açıklanmasına yardımcı oldu. Bir akım düşük basınçta bir gazdan geçtiğinde, atomların potansiyel enerjisi artar.
Temel durumundan daha yüksek potansiyel enerjiye sahip bir atomun heyecanlı bir durumda olduğu söylenir. Uyarılmış durum atomu kararsızdır ve temel duruma geri döner.
Bunu yaptığında, kaybedilen enerjiyi elektromanyetik radyasyon (foton) olarak verir. Bir elektrik akımı bir element gazından geçirildiğinde, karakteristik bir ışık rengi yayılır. Bu ışık, belirli dalga boylarında çeşitli ışık bantlarına ayrıldığı bir prizmadan geçirilebilir.
Bu bantlar, o eleman için hat emisyon spektrumu olarak bilinir. Hidrojen için hat emisyon spektrumu, matematiksel olarak ilk açıklanandır. Bilim insanları şimdi bu matematiksel ilişkiyi açıklayabilecek bir atom modeli geliştirme göreviyle karşı karşıya kaldılar.
Bohr Atom Modeli
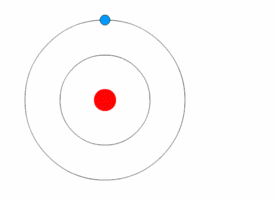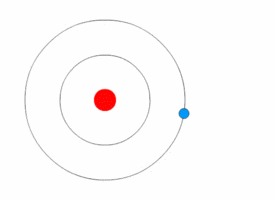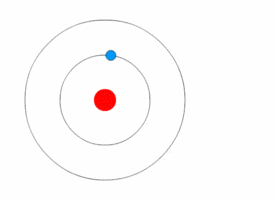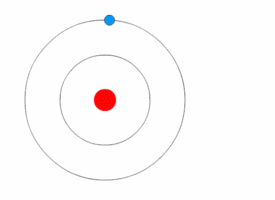
1913'te Danimarkalı teorisyen Niels Bohr (1885-1962) atomun nicelikli kabuk modelini geliştirdi. Bohr, Rutherford’un modelini, elektronların, sabit boyut ve enerjinin belirli bölgelerindeki çekirdeğin yörüngesinde döndüğünü varsayarak değiştirdi. Elektronun enerjisi yörüngenin büyüklüğüne bağlıdır. En küçük yörüngelerdeki elektronlar en az enerjiye sahiptir. Bir atom, elektronları mümkün olan en düşük enerjinin yörüngelerini işgal ettiğinde kararlıdır.
Bir elektron, uyarılmış durumdan temel durumuna düştüğünde, belirli bir enerjiyle bir foton yayılır. Fotonun enerjisi, iki yörünge arasındaki enerji farkına eşittir. Her bir fotonun enerjisi Planck denklemi E = hλ tarafından verilen belirli bir radyasyon frekansına karşılık gelir.
Bohr, hat emisyon spektrumunda yayılan ışığın dalga boylarını ölçerek bir hidrojen atomundaki elektronun enerjisini hesaplayabildi.
Bohr’un atom modeli çok kararlıydı çünkü elektron en küçük yörüngede olduğundan daha fazla enerji kaybedemedi. Bohr’un modeliyle ilgili büyük bir sorun, birden fazla elektronlu atomların özelliklerini açıklayamamasıydı ve 1920'lerin başında yeni bir atom modeli arayışına başlamıştı.
Modern Atom Modeli
Kuantum mekaniğinin gelişimi modern atom teorisinin temelini oluşturdu. 1922'de Amerikalı fizikçi Arthur H. Compton (1892-1962), Einstein'ın ışığın ikili doğası üzerine teorisini doğrulayan ve ilerleten x-ışını saçılım deneyleri gerçekleştirdi.
1923'te Fransız fizikçi Louis-Victor De Broglie (1892-1987), tüm maddenin yanı sıra radyasyonun hem parçacık hem de dalga olarak davrandığını önererek bu teoriyi genişletti. Bu zamana kadar, bilim insanları madde ve enerjiyi farklı yasalara uyan farklı fenomenler olarak görüyorlardı.
Broglie'nin önerisi, Avusturyalı fizikçi Erwin Schrödinger'in (1887-1961) matematiksel dalga denklemini geliştirdiği 1926'ya kadar deneysel veya matematiksel kanıtlarla desteklenmedi.
Schrödinger, elektronların da dalga gibi davrandığını öne sürdü. Dalga denklemi elektronların frekansını bulmak için kullanılabilir ve daha sonra karşılık gelen enerjiyi bulmak için Planck denklemi kullanılabilir.
Schrödinger denklemi, bir elektronun yeri ve enerjisinin Bohr’un modelinden çok daha kesin bir tanımını verdi. Birden fazla elektronu olan atomlar için de kullanılabilir. Ayrıca, denklemi kullanılarak sadece belirli frekans dalgaları çözülebilir.
Bu, bir atomdaki elektronlar için sadece belirli enerjilerin mümkün olduğunu gösterdi. Daha fazla deney, broglie'nin, elektronlar kırıldığı ve girişim sergilediği için maddenin dalgalar gibi davranabileceği iddiasında doğru olduğunu gösterdi.
1927'de Alman fizikçi Werner Heisenberg (1901-1976), şimdi Heisenberg belirsizlik ilkesi olarak bilinen şeyi geliştirdi.
Bu hipotez, bir elektronun veya herhangi bir hareketli parçacığın konumunun ve hızının aynı anda bilinemeyeceğini belirtir. Bu, dalga fonksiyonları olarak bilinen Schrödinger dalga denklemine yönelik çözümlerin, sadece belirli bir yörüngede bir elektron bulma olasılığını tarif edebileceği anlamına geliyordu.
Bu nedenle, elektronlar Bohr modelinde varsayıldığı gibi ayrı yörüngelerde yer almaz, bunun yerine yörünge adı verilen daha bulanık bir bölgede yer alırlar. Bir yörünge, izledikleri belirli bir yol yerine bir atomdaki elektronların olası bir yerini gösterir. Bir yörüngedeki elektronların olası yeri, kuantum sayıları adı verilen bir dizi sayı ile açıklanır.
Atomun kuantum modeli, bir atomdaki elektronların düzenini tanımlamak için dört kuantum sayısı kullanır, tıpkı bir adres gibi, bir sokaktaki evlerin yerlerini açıklar. Bu düzenleme elektron konfigürasyonu olarak bilinir. Bir atomun yer durumu elektron konfigürasyonu, bir atomdaki elektronların en düşük enerji düzenlemesini temsil eder.
Elektronların belirli bir konfigürasyona yerleştirilmesi üç prensibe dayanmaktadır.Birincisi, Aufbau prensibi, bir elektronun mümkün olan en düşük enerji yörüngesinde yer alacağını belirtir. Pauli dışlama ilkesi, bir atomdaki her elektronun kendine özgü dört kuantum sayı kümesine sahip olduğunu belirtir. Bir atomdaki iki elektron aynı kümeye sahip olmayacaktır.
Son olarak, Hund'un kuralı, her bir yörünge iki elektron tutabilse de, elektronların yörüngeleri işgal edeceği ve yalnızca bir elektronu olan maksimum sayıda yörünge olacağı anlamına gelir.
Alman bilim insanı Friedrich Hund (1896–1997) tarafından geliştirilen Hund’ un kuralı, bilim insanlarının elektronların bir atomun suborbital kabuklarını doldurma sırasını tahmin etmelerini sağlar. Hund' un kuralı, elektronların bir atomun mevcut en düşük enerji seviyesine eklendiğini belirten Aufbau prensibine dayanmaktadır.

Anahtar Kelimeler
Alfa parçacığı - Bazı radyoaktif bozunma sırasında iki proton ve iki nötron birbirine bağlanır ve çekirdekten yayılır.
Anot - Pozitif yüklü bir elektrot.
Katot — Negatif yüklü bir elektrot.
Elektromanyetik radyasyon - Hem parçacıkların hem de dalgaların özelliklerine sahip fotonların enerjisi. Başlıca dalga boyu bantları kısatan uzunluğa doğrudur: kozmik, ultraviyole, görünür veya “ışık” kızılötesi ve radyodur.
Kütlenin korunumu kanunu - Kütle, olağan kimyasal veya fiziksel reaksiyonlar sırasında ne yaratılır ne de yok edilir.
Belirli oranlar kanunu - Kimyasal bir bileşik, numunenin boyutuna veya bileşiğin kaynağına bakılmaksızın aynı elementleri kütle olarak tam olarak aynı oranlarda içerir.
Çoklu oranlar kanunu - İki veya daha fazla farklı bileşik aynı iki elementten oluşuyorsa, ikinci elementin kütlelerinin, birinci elementin belirli bir kütlesi ile birleştirilmesi her zaman küçük tam sayıların oranıdır.
Pozitron(Elektorunun Anti maddesi) - Elektronla aynı kütle ve yük büyüklüğüne sahip pozitif yüklü bir parçacık.
Potansiyel enerji - Depolanmış enerji.
Kuarklar - Proton ve nötronların en temel birimleri olduğuna inanılmaktadır.
Atomaltı parçacık - Bir atomdan daha küçük temel bir parçacık. Protonlar, nötronlar ve elektronlar atom altı parçacıklara örnektir.
Kaynaklar
Brown, Theodore E., vd. Kimya: Merkezi Bilim . 10. baskı. Yukarı Eyer Nehri, NJ: Prentice Hall, 2005.
Cook, Norman D. Atom Çekirdeğinin Modelleri . New York : Springer, 2006.
Heilbron, JL Ernest Rutherford ve Atom Patlaması . New York : Oxford University Press, 2003.
Lodge, Oliver. Atomlar ve Işınlar: Atomik Yapı ve Radyasyon Üzerine Modern Görüşlere Giriş . Kila, MT: Kessinger Yayınları, 2003.
DİĞER
Parçacık Veri Grubu. Lawrence Berkeley Ulusal
Laboratuar. “ Parçacık Macerası: Maddenin ve Kuvvetin Temelleri ” < http://particleadventure.org/particleadventure/ > (erişim 17 Ekim 2006).
K. Lee Lerner
Jennifer McGrath
 Önceki Yazı
Önceki Yazı
 Sonraki Yazı
Sonraki Yazı